Lecanemab: G-BA sieht keinen Zusatznutzen für Alzheimer-Mittel Leqembi | ABC-Z
In Fachkreisen gelten Antikörper zur Behandlung von Alzheimer als Meilenstein. Sie attackieren die Ursache der Erkrankung und können den Patienten helfen, länger selbständig zu leben. Doch der Gemeinsame Bundesausschuss (G-BA), in dem Vertreter von Kliniken und Krankenkassen sowie Ärzte sitzen, hat nun darüber beraten, ob der Alzheimerantikörper Lecanemab für Patienten in Deutschland wirklich nützlicher ist als die bisherigen Therapien. Die Experten kommen zu dem Schluss, dass das nicht der Fall ist. Ältere Therapien sind demnach genauso wirksam wie das neue Mittel.
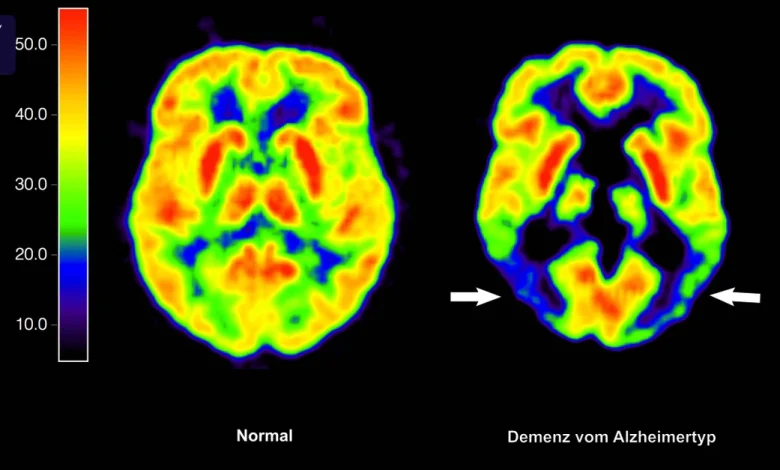
Lecanemab (Handelsname: Leqembi) ist der erste Wirkstoff in Deutschland, der die Bildung und Ablagerung der typischen Plaques in den Gehirnen der Betroffenen verlangsamen kann. In manchen Fällen wurden Plaques sogar wieder aufgelöst. Das zeigen Aufnahmen der Gehirne von Betroffenen. Aber was ist mit dem Erkrankungsbild? Geht es den Patienten dank der Lecanemab-Infusionen wirklich länger besser?
Die Experten bewerteten genau dies: die Symptomatik und die Lebensqualität der Patienten. Und hier, so schreibt es der G-BA, wirke der Antikörper nicht besser als bisherige Behandlungen, die nicht auf die Ursache, sondern nur auf die Symptome zielten.
Wird die Therapie sofort gestoppt?
Und nun? Werden Patienten, die das Mittel bisher bereits bekommen, nicht weiter behandelt werden können? Und können Patienten, die die Diagnose neu bekommen, nicht an die Therapie kommen?
So drastisch ist es nicht: Vorerst können Ärzte Lecanemab weiter verordnen. Ob das langfristig der Fall ist, muss sich zeigen. Denn die Bewertung des G-BA hat einen großen Einfluss darauf, welchen Preis Krankenkassen für das Medikament zu zahlen bereit sind. Wollen sie wenig zahlen, kann der Hersteller Esai das Medikament vom deutschen Markt nehmen.
Im konkreten Fall sei das Problem, dass Lecanemab etwa hundertfach teurer ist als die schon länger verfügbaren, auf Symptome abzielenden Mittel, sagt Peter Berlit, Generalsekretär der Deutschen Gesellschaft für Neurologie.
Wenn kein Zusatznutzen gesehen wird, darf der Preis des neuen Medikaments nicht allzu stark von dem anderer Arzneimittel abweichen. In diesem Falle sind dies etwa Acetylcholinesterase-Hemmer. Durch sie fallen Behandlungskosten von etwa 250 Euro pro Patient und Jahr an – anstelle von 25.000 Euro für die Antikörpertherapie.
So tief senken werde der Hersteller den Preis bei Lecanemab aber sehr wahrscheinlich nicht – und es stattdessen womöglich lieber vom deutschen Markt nehmen. Für die Verhandlungen gibt es einen Zeitraum von sechs Monaten. „Danach wird Lecanemab in Deutschland womöglich nicht mehr angeboten“, sagt Berlit.
Nur wenige Hundert Patienten
Bisher erhalten nur wenige Hundert Patienten in Deutschland Infusionen mit dem Antikörper. Die Kriterien, für wen sie geeignet sind, sind sehr eng. So müssen bestimmte Genvarianten (Apo-E4) bei den Patienten ausgeschlossen werden, ihre Symptome dürfen nur sehr leicht sein. Wer die Infusionen erhält, muss zudem regelmäßig im MRT untersucht werden, um schwere Nebenwirkungen wie Hirnblutungen auszuschließen. Bisher werden die Infusionen vorwiegend an großen Kliniken durchgeführt. Patienten nehmen lange Strecken auf sich, um die Therapie zu erhalten.
Der Vorteil, den diese Patienten laut Zulassungsstudien haben: Ihr Krankheitsverlauf wird gebremst, bei einer Therapiedauer von 18 Monaten um bis zu sechs Monate.
Seit der Zulassung des Antikörpers in Deutschland im September 2025 wird den Patienten die Therapie für sechs Monate von ihren Krankenkassen erstattet. Der Hersteller hatte zuvor den Preis festgelegt. In der Zwischenzeit war der G-BA aufgerufen, den Zusatznutzen des Mittels zu prüfen. Es war auch ein Gutachten des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) erstellt worden: Deren Experten waren bereits zu dem Schluss gekommen, dass Lecanemab gegenüber den bisher eingesetzten Mitteln, etwa Acetylesterase-Hemmern, keinen zusätzlichen Nutzen hat. Der G-BA teilt diese Einschätzung. Im nächsten Schritt wird der Spitzenverband der gesetzlichen Krankenkassen den Preis mit dem Hersteller Esai aushandeln. Kommt es zu keiner Einigung, kann Esai das Mittel vom Markt nehmen.
Hersteller kann weitere Daten liefern
Und die Patienten? Neurologe Berlit sagte gegenüber der Deutschen Presseagentur (dpa), dass die Lecanemab-Therapie generell beendet würde, wenn die Erkrankung ein mittelschweres Stadium erreicht habe. Gegebenenfalls aber würden die Patienten so bereits früher als bisher auf andere Mittel umgestellt.
Im Rahmen von Studien etwa in Hochschulambulanzen – finanziert über Drittmittel und nicht über die Kassen – könne und werde es auch bei einem Markt-Aus weiterhin Lecanemab-Behandlungen geben. Unklar sei derzeit, inwieweit private Kassen das Mittel übernehmen. Für Selbstzahler sei es generell weiterhin verfügbar, über die Internationalen Apotheken zu internationalen Preisen.
„Kein Zusatznutzen bedeutet nicht, dass der Wirkstoff nutzlos ist“, betont der G-BA-Vorsitzende Josef Hecken im Gespräch mit der dpa. Es gehe dabei darum, ob der Wirkstoff Vorteile im Vergleich zu bislang in Deutschland angewendeten Behandlungen hat. Neue Daten des Herstellers könnten künftig möglicherweise einen solchen Zusatznutzen noch belegen.
Er hoffe nicht, dass es bei Lecanemab dazu komme, dass der Hersteller mangels einer Einigung das Mittel vom Markt nimmt, sagt Hecken. Es seien bereits etliche Mittel ohne belegten Zusatznutzen auf dem deutschen Markt geblieben, etwa gegen Diabetes oder Krebs. Oft seien dann im Laufe der Zeit weitere Daten vorgelegt worden, „die dazu geführt haben, dass hier ein Zusatznutzen ausgesprochen werden konnte“. Das könnte auch bei Lecanemab geschehen.
Über den zweiten Alzheimer-Wirkstoff in Deutschland, Donanemab (Handelsname Kisunla), will der G-BA Mitte April entscheiden. Auch hier sieht das IQWiG keinen Zusatznutzen.






















